Abb.1 : Zum Gleichgewichtszustand von luftgesättigtem Wasser: Gleichgewicht herrscht dann, wenn der Partialdruck des in Wasser gelösten Sauerstoffs den atmosphärischen O 2 -Partialdruck gerade aufhebt.

Sauerstoff löst sich nicht so in Wasser, wie man es bei Salzen kennt, deren Kristalle sich in wässriger Lösung aufspalten (dissoziieren). Die Moleküle von Gasen, die in der Luft enthalten sind, also auch von Sauerstoff, drängen sich zwischen die Wassermoleküle, so dass man eher von einem Stoffgemisch als von einer Lösung sprechen kann. Die Triebkraft für das Eindringen der Gasteilchen in die Flüssigkeit ist der atmosphärische Luftdruck, über den sie die erforderliche Energie beziehen.

Abb.1
: Zum Gleichgewichtszustand von luftgesättigtem Wasser:
Gleichgewicht herrscht dann, wenn der Partialdruck des in Wasser
gelösten Sauerstoffs den atmosphärischen O 2 -Partialdruck gerade
aufhebt.
Der Gesamtluftdruck setzt sich additiv aus den Drücken der einzelnen Gase zusammen. Der Einzeldruck heißt Partialdruck des betreffenden Gases. In einem Wasserbehälter, der eine unendlich lange Zeit der Luft ausgesetzt ist, würde sich ein Gleichgewicht der Partialdrücke der Gase ausbilden, mit den Anteilen, wie sie in der Luft enthalten sind, also ca. 21% O 2 , ca. 70% N 2 und entsprechend andere Gase. Wie lange es dauert, dieses Gleichgewicht annähernd einzustellen, hängt von mehreren Faktoren ab, z. B. Temperatur, Bewegung des Wassers und Oberfläche, über die der Austausch stattfinden kann.
Bringt man ein anderes Gas in die Flüssigkeit ein, wie etwa CO 2 , das durch die Atmung der Fische entsteht, oder mehr Sauerstoff, den Wasserpflanzen erzeugen, verschiebt sich das Gasgleichgewicht, welches sich immer im gleichen Verhältnis zum äußeren Luftdruck einstellt, nun aber durch eine neue Partialkomponente erweitert wird. Um die ursprünglichen Verhältnisse wieder herzustellen, findet ein Gasaustausch über die Wasseroberfläche statt, der aber eine gewisse Zeit braucht. Das Gleiche geschieht natürlich auch durch den Verbrauch eines Gases.
Das heißt also, nicht nur durch den Verbrauch eines Gases, sondern auch durch Zuführen eines anderen Gases kann ein Mangel entstehen. Dies ist nicht nur bei der Sauerstoffversorgung von Fischen zu beachten, sondern besonders dann, wenn neben den Fischen auch Pflanzen gezüchtet werden sollen, die CO 2 benötigen und bei zu hoher Sauerstoffzufuhr (wie durch den Sprudelstein) keine optimalen Bedingungen vorfinden würden.
Es ist nicht nur hier, sondern auch in vielen anderen Fällen nützlich, den O 2 -Gehalt im Wasser feststellen zu können. So kann man beispielsweise den Zustand eines Sees durch Informationen über den Sauerstoffgehalt im Wasser bestimmen; er gibt Aufschlüsse über den von Algen verursachten Sauerstoffverbrauch oder über die Austauschsituation zwischen verschiedenen Wasserschichten und zwischen Wasser und Luft.
Bei der Bestimmung des O2 -Gehaltes kann man zwei unterschiedliche Werte angeben: 1. Messung der absoluten Menge des im Wasser enthaltenen Sauerstoffs in mg Sauerstoff pro Liter Wasser ( mg/l ). Sämtliche chemischen Verfahren basieren auf der Absolutbestimmung, die Werte müssen immer im Zusammenhang mit der Temperatur während der Messung gesehen werden. Diese Angabe ist dann aussagefähig, wenn das Wasser über längere Zeit konstante Temperatur hat oder wenn es nicht auf ein Gleichgewicht ankommt, sondern nur eine gewisse Grundversorgung mit O 2 gewährleistet werden soll.
Messung in Prozent Sättigung ( %sat ), das bedeutet Angabe der enthaltenen Sauerstoffmenge im Verhältnis zum maximal möglichen Sauerstoffgehalt, der sich bei normaler Luftzusammensetzung und festgelegtem Druck und Temperatur nach unendlich langer Zeit einstellen würde (dieser wird mit 100 % festgelegt). Bei zu großem O 2 -Anteil kann es zu Über-, bei zu kleinem zu Untersättigung kommen.
Der Vorteil der Angaben in %sat sind temperaturunabhängige Messwerte, die anzeigen, ob sich die gelösten Gase im Wasserbecken im Gleichgewicht befinden, oder ob die Gefahr eines "Umkippens" besteht. Eine direkte Bestimmung dieser Werte ist nur mit elektronischen Meßsystemen möglich.
Welche Möglichkeiten hat nun der Aquarianer oder Fischzüchter, den Sauerstoffgehalt zu bestimmen?
Grundsätzlich gibt es zwei Wege, erstens die verschiedenen mehr oder weniger genauen chemischen Verfahren, die ab einer bestimmten Güte eine umfangreiche Laborausstattung erfordern und zweitens die immer mehr auf dem Markt angebotenen elektrochemischen O 2 - Sensoren, mit denen man den Sauerstoffgehalt direkt und "online" bestimmen kann, deren Anschaffung sich aber erst lohnt, wenn häufiger gemessen werden muss oder eine kontinuierliche Überwachung stattfinden soll. Im Folgenden sollen sie kurz vorgestellt
werden:
Sie funktionieren wie Indikatorpapier für Säuren und Laugen, man hält sie in die Messlösung und sieht am Farbumschlag, wie viel Sauerstoff enthalten ist.
Ist wohl die genaueste, aber auch aufwendigste Methode, den O 2 - Gehalt chemisch zu bestimmen. Man erreicht eine Genauigkeit von 0,03 mg/l.
Bei der Titration wird der Sauerstoff in der Messlösung zuerst mit einer jodhaltigen Zugabe gebunden, danach wird diese Lösung zur Einfärbung mit Stärke versetzt. So vorbereitet wird in die Messlösung langsam der sogenannte Titer getropft bis sie sich komplett entfärbt hat. Den Sauerstoffgehalt kann man nun aus der Menge des aufgetropften Titers bestimmen. Die Mindestausstattung für die Winkler-Titration sind geeichte Schliffkolben und eine Tropfpipette, dazu braucht es einige Erfahrung bei der Durchführung der Messung.
Erst mit der Entwicklung dieser Sensoren ist es möglich geworden, den Sauerstoffgehalt einer Lösung ohne Zeitverzug ablesen zu können (online- Messung). Die eigentliche Messzelle ist von der Messlösung durch eine Membran getrennt, durch die ständig Sauerstoff hindurchdiffundiert, der an der Kathode reduziert wird (Abb.2). Dabei werden Ladungsträger (Elektronen) frei, die zur Anode fließen und dadurch einen Strom erzeugen, der von der Menge des vorhandenen Sauerstoffs abhängig ist. Der Strom liegt im nA-Bereich, mittels geeigneter Messverstärker kann man ihn zur Anzeige bringen. Durch eine gleichzeitige Messung der Temperatur der Messlösung mittels NTC wird das Signal elektronisch soweit aufgearbeitet, dass man auf einem Display den O 2 - Gehalt entweder in mg/l oder in %sat direkt ablesen kann.
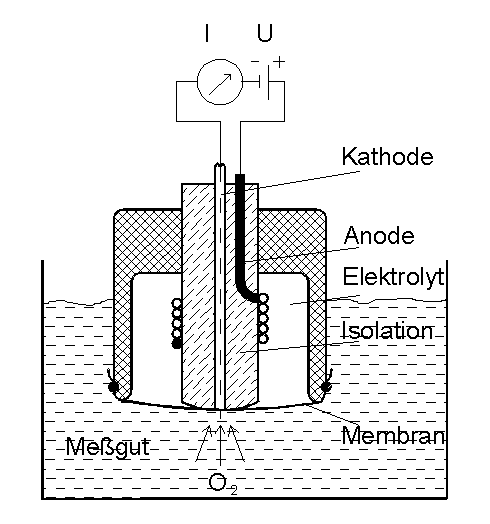
Abb.2
: prinzipieller Aufbau der Sauerstoff-Messzelle (Clark-Zelle)
Die elektrochemischen Systeme werden in Zukunft immer mehr an Bedeutung gewinnen, da sie allen Anforderungen an fortschrittliche Messtechnik genügen. Der erste große Vorteil liegt auf der Hand: Man kann sofort ablesen, wie groß der Sauerstoffgehalt ist und es ist auch möglich, eine Tendenz nach oben oder unten zu erkennen, so dass man frühzeitig auf Störungen des Gleichgewichtes reagieren kann. Weiterhin ermöglichen elektrochemische Sensoren eine ständige Überwachung über lange Zeiten und können damit auch Regelaufgaben übernehmen. Natürlich kann man die Messgeräte auch über eine meist analoge Schnittstelle (eine Frage des Preises) mit einem Computer verbinden und so in die Komplettüberwachung des Aquariums (z.B. Futter, Temperatur, Nitrate, DO einbinden.